Classe Pharmacothérapeutique
Classe pharmacothérapeutique : Anti-inflammatoire non stéroïdien à usage topique, code ATC : M02AA15.
L’hydroxyéthylpyrrolidine de diclofénac ou épolamine de diclofénac est un sel de diclofénac soluble dans l’eau.
Le diclofénac est un anti-inflammatoire non stéroïdien dérivé de l’acide phénylacétique appartenant au groupe des acides aryl carboxyliques.
Sous forme d’emplâtre médicamenteux, il possède une activité locale anti-inflammatoire et antalgique. Indications thérapeutiques
Traitement symptomatique local de la douleur et de l’inflammation d’origine rhumatismale ou traumatique affectant les articulations, les muscles, les tendons ou les ligaments. Contre-indications
Ce médicament est contre-indiqué dans les cas suivants:
· Hypersensibilité au diclofénac, à l’acide acétylsalicylique ou aux autres anti-inflammatoires non stéroïdiens (AINS) ou à l’un des excipients de ce produit listés à la rubrique 6.1.
· Patients chez lesquels les crises d’asthme, d’urticaire ou de rhinite aiguë sont provoquées par l’acide acétylsalicylique ou d’autres médicaments anti-inflammatoires non stéroïdiens (AINS).
· Peau lésée, quelle que soit la lésion: dermatoses suintantes, eczéma, lésion infectée, brûlure ou plaie.
· A partir du début du 6ème mois de la grossesse (voir rubrique 4.6 Grossesse et allaitement).
· Patients souffrant d’un ulcère peptique évolutif.
· Chez l’enfant et l’adolescent âgé de moins de 16 ans.
Précautions d’emploi et mises en garde spéciales
· L’emplâtre médicamenteux ne doit être appliqué que sur une peau saine, non lésée, et non pas sur des plaies cutanées ou des blessures ouvertes, et ne doit pas être porté lors des bains ou des douches.
· L’emplâtre médicamenteux ne doit pas être mis en contact ni appliqué sur les muqueuses ou sur les yeux.
· Ne pas utiliser sous pansement occlusif.
· L’apparition d’une éruption cutanée après application de DICLOFENAC URGO 140 mg, emplâtre médicamenteux impose l’arrêt immédiat du traitement.
· L’administration concomitante de médicaments contenant du diclofénac ou d’autres AINS, que ce soit par voie locale ou par voie générale, est à proscrire.
· La survenue d’effets indésirables d’ordre systémique après l’application de diclofénac en topique ne peut être exclue en cas d’utilisation prolongée (voir les informations produit sur les formes systémiques de Diclofenac). Bien que les effets systémiques soient peu fréquents, l’emplâtre médicamenteux doit être utilisé avec précaution chez les patients présentant une altération de la fonction rénale, cardiaque, ou hépatique, chez les patients présentant des antécédents d’ulcère digestif, de maladie intestinale inflammatoire ou de saignements digestifs. Les anti-inflammatoires non stéroïdiens doivent être utilisés avec précaution chez les personnes âgées qui sont davantage sujettes aux effets indésirables.
· Ce médicament contient du parahydroxybenzoate de méthyle et du parahydroxybenzoate de propyle. Il peut causer des réactions allergiques (possibilité d’allergie retardée). Il contient également du propylène glycol pouvant causer une irritation cutanée.
· Afin de réduire tout risque de photosensibilisation, les patients doivent être informés d’éviter toute exposition aux rayonnements solaires (soleil ou cabine UV).
· Les bronchospasmes peuvent être provoqués chez les patients présentant un asthme bronchique, une maladie allergique ou une allergie à l’acide acétylsalicylique ou à un autre AINS ou ayant des antécédents de ces pathologies. L’emplâtre médicamenteux doit être utilisé avec précaution chez les patients présentant ou non un asthme chronique, chez lesquels les crises d’asthme, d’urticaire ou de rhinites aiguës sont provoquées par l’acide acétylsalicylique ou d’autres anti-inflammatoires non stéroïdiens (voir rubrique 4.3 Contre-indications). Afin de minimiser la survenue d’effets indésirables, il est recommandé d’utiliser la dose minimale efficace pour contrôler les symptômes pendant la période la plus courte possible, sans dépasser le maximum autorisé de 14 jours.
Interactions avec d’autres médicaments
En raison du faible passage systémique lors d’un usage normal de DICLOFENAC URGO 140 mg, emplâtre médicamenteux, les interactions médicamenteuses signalées pour le diclofénac per os sont peu probables. Utilisation pendant la grossesse et l’allaitement
Grossesse
La concentration systémique de diclofénac est plus faible après une administration topique, par rapport aux formulations orales.
En référence au traitement par les AINS par voie systémique, il est recommandé de :
L’inhibition de la synthèse des prostaglandines peut affecter le déroulement de la grossesse et/ou le développement de l’embryon ou du fœtus. Les données des études épidémiologiques suggèrent une augmentation du risque de fausse-couche, de malformations cardiaques et de gastroschisis, après traitement par un inhibiteur de la synthèse des prostaglandines en début de grossesse. Le risque absolu de malformation cardiovasculaire passe de moins de 1 %, à approximativement 1,5 %. Le risque paraît augmenter en fonction de la dose et de la durée du traitement. Chez l’animal, il a été montré que l’administration d’un inhibiteur de la synthèse des prostaglandines provoquait une perte pré et post-implantatoire accrue et une augmentation de la létalité embryo-fœtale. De plus, une incidence supérieure de certaines malformations, y compris cardiovasculaires, a été rapportée chez des animaux ayant reçu un inhibiteur de la synthèse des prostaglandines au cours de la phase d’organogénèse de la gestation.
Sauf nécessité absolue, le diclofénac ne doit donc pas être donné au cours du premier et du second trimestre de la grossesse. Si le diclofénac est administré chez une femme souhaitant être enceinte ou durant le premier ou le second trimestre de la grossesse, la dose devra être la plus faible possible et la durée du traitement la plus courte possible.
Pendant le troisième trimestre de la grossesse, l’utilisation des inhibiteurs de la synthèse des prostaglandines peut exposer le fœtus à:
· une toxicité cardio-pulmonaire (fermeture prématurée du canal artériel et hypertension artérielle pulmonaire),
· un dysfonctionnement rénal, pouvant évoluer vers une insuffisance rénale associée à un oligohydroamniosis.
· la mère et le nouveau-né, en fin de grossesse, à:
· un risque d’allongement du temps de saignement, un effet antiagrégant qui peut se produire même à de très faibles doses,
· une inhibition des contractions utérines, entraînant un retard de terme ou un accouchement prolongé.
Par conséquent, le diclofénac est contre-indiqué au cours du troisième trimestre de la grossesse.
Allaitement
Le diclofénac, comme tous les AINS, passe dans le lait maternel en petites quantités. Cependant, aux doses thérapeutiques de l’emplâtre médicamenteux au diclofénac, aucun effet sur l’enfant allaité n’est attendu.
En raison d’un manque d’études contrôlées chez les femmes qui allaitent, le produit ne doit être utilisé pendant l’allaitement que sur les conseils d’un professionnel de la santé. Ainsi, DICLOFENAC URGO 140 mg, emplâtre médicamenteux ne doit pas être appliqué sur les seins des mères allaitantes ni sur d’autres zones sur de grandes surfaces cutanées ou pendant une période prolongée Effets sur l’aptitude à conduire des véhicules ou à utiliser des machines
DICLOFENAC URGO 140 mg, emplâtre médicamenteux n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines. Posologie, Mode et/ou voie(s) d’administration, Fréquence d’administration et Durée du traitement:
Voie cutanée uniquement.
Posologie
Un (1) emplâtre sur la région la plus douloureuse une ou deux fois par jour.
Durée d’administration
L’utilisation de DICLOFENAC URGO 140 mg, emplâtre médicamenteux doit être la plus courte possible. La durée maximale de traitement est de 14 jours consécutifs.
Sujet âgé
Ce médicament doit être utilisé avec précaution chez les personnes âgées qui sont davantage sujettes aux effets indésirables (voir également rubrique 4.4).
Enfants et adolescents de moins de 16 ans
Ce médicament ne doit pas être utilisé chez l’enfant de moins de 16 ans compte tenu du manque de données concernant la sécurité d’emploi et l’efficacité. Voir également rubrique 4.3.
Chez les enfants âgés de 16 ans ou plus, si le produit est utilisé pendant plus de 7 jours pour soulager la douleur, ou si les symptômes persistent, il est conseillé au patient/parent de l’adolescent de consulter un médecin.
Insuffisance hépatique ou rénale
Pour l’utilisation de DICLOFENAC URGO 140 mg, emplâtre médicamenteux chez les patients avec une insuffisance hépatique ou rénale se référer à la rubrique 4.4.
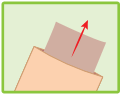
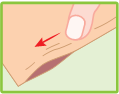
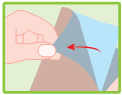
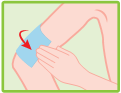
Mode d’administration
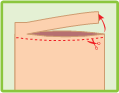
Couper l’enveloppe contenant les emplâtres médicamenteux à l’endroit indiqué. Retirer un emplâtre médicamenteux, enlever le film plastique qui protège la surface adhésive et l’appliquer sur la région ou l’articulation douloureuse. Si nécessaire, il peut être maintenu en place par un filet élastique. Refermer soigneusement l’enveloppe au moyen de la glissière.
L’emplâtre doit être utilisé intact.
Symptômes et instructions en cas de surdosage
Il n’existe pas de cas documentés de surdosage liés à l’utilisation d’un emplâtre médicamenteux au diclofénac. Dans l’éventualité de l’apparition d’effets indésirables systémiques liés à une utilisation incorrecte ou à un surdosage accidentel (par exemple chez l’enfant) de ce produit, les mesures générales de prise en charge d’une intoxication par des anti-inflammatoires non stéroïdiens doivent être appliquées.
Description des effets indésirables éventuels
Les effets indésirables (Tableau 1) sont classés par fréquence, le plus fréquent en premier, de la manière suivante: très fréquent: (>1/10); fréquent (≥1/100, <1/10); peu fréquent (≥1/1,000, <1/100); rare (≥1/10,000, <1/1,000); très rare (<1/10,000); Fréquence indéterminée : ne peut être estimée sur la base des données disponibles.
Infections et infestations
Très rare
Eruption pustuleuse
Trouble du système immunitaire
Très rare
Hypersensibilité (y compris urticaire), œdème angioneurotique, réaction de type anaphylactique
Troubles respiratoires, thoraciques et médiastinaux
Très rare
Asthme
Réactions cutanées et des tissus sous-cutanés
Fréquent
Peu fréquent
Rare
Très rare
Eruption cutanée, eczéma, érythème, dermatite (y compris dermatite allergique et de contact), prurit
Pétéchie
Dermatite bulleuse (ex : érythème bulleux), peau sèche
Réaction de photosensibilité
Troubles généraux et incidents liés au site d’administration
Fréquent
Peu fréquent
Réaction au site d’application
Sensation de chaleur
L’absorption systémique du diclofénac est très faible comparée aux taux plasmatiques observés après l’utilisation de formes orales de diclofénac et la probabilité de survenue d’effets indésirables d’ordre systémique (tels que des troubles gastriques, hépatiques et rénaux) est très faible comparée à la fréquence de tels effets associés au diclofénac par voie orale. Cependant, lorsque DICLOFENAC URGO 140 mg, emplâtre médicamenteux est appliqué sur une surface de peau relativement étendue et pendant une période prolongée, la possibilité de survenue d’effets indésirables systémiques ne peut être exclue.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance – Site internet : www.signalement-sante.gouv.fr. Conditions de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
3 ans.
Après première ouverture de l’enveloppe scellée : 4 mois. Substances actives
Chaque emplâtre médicamenteux de 10 cm x 14 cm contient 180 mg d’épolamine de diclofénac correspondant à 140 mg de diclofénac sodique.
Excipient(s) à effet notoire :
Parahydroxybenzoate de méthyle (E218) : 14 mg
Parahydroxybenzoate de propyle (E216) : 7 mg
Propylène glycol : 420 mg
Quantité rapportée à un emplâtre. Autres composants
Support : support non tissé polyester.
Support : support non tissé polyester.
Couche adhésive (gel actif) : gélatine, povidone (K90), sorbitol liquide (non cristallisable), kaolin lourd, dioxyde de titane (E171), propylène glycol, parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), édétate disodique, acide tartrique, glycinate d’aluminium, carmellose sodique, polyacrylate de sodium, 1,3-butylène glycol, polysorbate 80, eau purifiée.
Film protecteur : film polypropylène.



























 Parapharmacie
Parapharmacie
Avis
Effacer les filtresIl n’y a pas encore d’avis.